担当:寺島 裕也(tera{a}rs.tus.ac.jp)
遠田 悦子(etsutoda{a}rs.tus.ac.jp)
免疫細胞の動きと活性をコントロールして新薬を患者さんへ届ける研究
免疫細胞遊走とは、炎症時に分泌されるケモカイン/サイトカイン、生理活性脂質などの遊走因子の刺激を受け、免疫細胞が血管内から組織内に浸潤し、迅速に炎症局所へ移動・集積する現象です。免疫細胞遊走は生体を防御する免疫機構に必須な現象であるとともに、がん、および、関節リウマチ、動脈硬化症などの慢性炎症性疾患にも密接に関与しています。私たちが発見した新規ケモカイン受容体会合分子「フロント」によるケモカインシグナルの分子制御メカニズムに関する基礎研究と、そこから得られた知見を活かし、がんおよび慢性炎症性疾患を治療する新薬の候補物質を探索する創薬開発研究を行っています。最近では、フロントが細胞遊走のみならず、細胞の活性化や分極化などこれまで考えられていた以上に多様な生命現象に関与していることが明らかになりつつあります。それに伴い、当グループでは熊本大学、東京大学、千葉県がんセンター、国立がんセンター、星薬科大学、東京工業大学、名城大学、東京理科大学などの様々な分野の研究者の方々との共同研究を通して研究を進めております。
基礎研究~免疫細胞遊走メカニズムの解明
免疫細胞遊走機構解明の新たな切り口
細胞遊走にはケモカイン受容体の細胞膜近傍C末端領域(Pro-C)を欠損させると遊走に障害がでることから、この領域は細胞遊走に重要な働きをしていると考えられてきました。しかしながらこの領域が具体的に何をしているのかは不明でした。私たちはこの領域には細胞遊走機構のカギとなる未知の分子が結合すると考え、その探索を行いました。標的としたケモカイン受容体はCCR2(松島教授により発見されたケモカイン、CCL2の受容体)です。CCR2はマクロファージや樹状細胞、活性化T細胞に発現し、炎症時のこれらの免疫細胞の動きを制御しています。わたしたちはマクロファージ細胞株のcDNAライブラリーから、CCR2のPro-C領域に結合し、かつ細胞遊走を促進する作用をもつ新規分子を発見し、「フロント」と名付けました。
免疫細胞の動きと活性を制御する分子フロント
生体内では免疫細胞は非常に希薄なケモカイン濃度勾配を感知して炎症局所に移動していると考えられます。濃度勾配を感知した細胞では遊走細胞に特徴的な前後の極性をもった形態をとりますが、これに先立って細胞内の細胞骨格を制御する分子配置に極性が生じています。細胞先導端にてPI3Kが活性化し、細胞骨格制御の実効分子のひとつであるPIP3を産生します。ただ、ケモカイン受容体の細胞表面における均一な分布と、PI3Kの活性化との間にはギャップがあり、分子配置の極性化を誘導する初期シグナル機構はまだよくわかっていません。私たちはフロントとPI3Kの関わりを解析し、フロントがPI3K活性化の制御に関わり、細胞遊走を促進することを明らかにしました(図1、図2)。現在、フロントの機能解析とファミリー分子の探索を行っています。
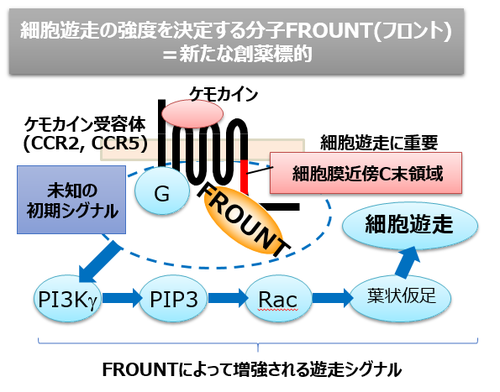
図1)ケモカインシグナルを制御する「フロント」
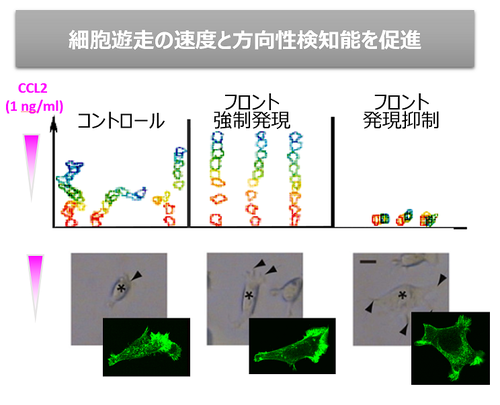
図2)「フロント」はケモカインシグナル促進分子
応用研究~免疫細胞を調節する新薬の開発
免疫細胞の働きを調節できる物質の探索
フロントの特性として、動物種間で高度に保存されている、ケモカイン受容体(CCR2とCCR5)に作用することが挙げられます。これは創薬のターゲットとして大きなメリットです。炎症性疾患の治療薬として、炎症の原因となる免疫細胞の遊走を媒介するケモカインの作用を阻害する薬の開発が世界中で行われています。その多くがケモカインとケモカイン受容体の結合を阻害するものですが、ケモカイン受容体の細胞外領域は種差が大きいために開発段階において実験動物では効果があっても臨床試験では効果が得られない、副作用が大きいといった問題から、これまでに開発は成功していません。私たちは、フロントはこうした潜在的な問題を払拭する新しい炎症性疾患治療薬のターゲットであると考え、フロントの機能を調節する物質の探索を行っています(図3、図4)。

図3)「フロント」制御薬の開発概要
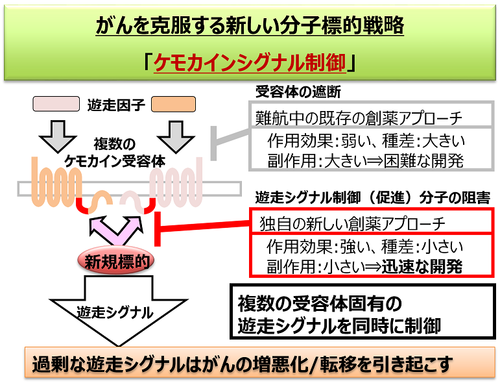
図4)「フロント」制御薬に期待されるメリット
実用化を目指した研究
上記の探索により見出された機能調節物質は、薬物動態解析や安全性試験などの非臨床研究とその後の臨床研究を通してはじめて患者さんのもとへ届けることがでます。また、この研究を通して得られた知見を新薬の探索技術や疾患の新たな診断技術として活用することもできます。これらは実用化研究といわれ、これまでは大学などのアカデミアではなく、製薬企業の仕事と考えられることも多かった研究開発です。しかし、本邦での医薬品開発には、アカデミアにおける基礎研究成果の製薬企業への橋渡しに問題を抱えています。私たちは新薬や新たな診断技術の実用化までを見据えた基礎・応用研究からこの状況を変えたいと考えております。
日本発の新薬や、新たな診断技術の実用化に興味のある学生さんはいつでもご連絡ください(tera@rs.tus.ac.jp)。
